







生物技术通报 ›› 2022, Vol. 38 ›› Issue (4): 295-302.doi: 10.13560/j.cnki.biotech.bull.1985.2021-0924
付偲僮( ), 司未佳, 刘颖, 程堂仁, 王佳, 张启翔, 潘会堂(
), 司未佳, 刘颖, 程堂仁, 王佳, 张启翔, 潘会堂( )
)
收稿日期:2021-07-16
出版日期:2022-04-26
发布日期:2022-05-06
通讯作者:
潘会堂,男,博士,教授,博士生导师,研究方向:花卉资源与育种、栽培生理与技术以及花卉在人居环境中的应用;E-mail: htpan@bjfu.edu.cn作者简介:付偲僮,女,硕士研究生,研究方向:花卉资源与育种;E-mail: Fusitong01@163.com
基金资助:
FU Si-tong( ), SI Wei-jia, LIU Ying, CHENG Tang-ren, WANG Jia, ZHANG Qi-xiang, PAN Hui-tang(
), SI Wei-jia, LIU Ying, CHENG Tang-ren, WANG Jia, ZHANG Qi-xiang, PAN Hui-tang( )
)
Received:2021-07-16
Published:2022-04-26
Online:2022-05-06
摘要:
小报春是报春花科报春花属的二年生草本花卉,具有较高的观赏价值和园林应用前景,是研究花柱二型的理想材料,建立快速高效的报春花属基因功能验证技术,是小报春基因功能研究中的关键问题。以小报春为材料,以八氢番茄红素脱氢酶(PDS)基因作为标记基因,探索TRV病毒载体在小报春中的最佳侵染对象、侵染液配方、菌液浓度和侵染方式,建立适用于小报春的VIGS体系。结果表明,用含有200 μmol/L乙酰丁香酮(AS)、10 mmol/L MgCl2和10 mmol/L乙磺酸缓冲液(MES)的浸染液,将含有pTRV1和pTRV2-PfPDS的菌液OD600值均调至1.0等体积混合后通过叶背注射方式侵染小报春,以TRV病毒载体上的引物对处理后的植株叶片进行PCR,在出现表型变化的植株和空载组中均检测到TRV1和TRV2的病毒载体,白化植株的PfPDS表达量显著低于空载组和对照组。建立的VIGS体系侵染效率达60%,沉默表型可持续12个月之久,并能在小报春植株的各部位(从叶片到萼片)均起到沉默作用。建立了小报春基因沉默体系,由于沉默效果持续时间长,所有基因都可以利用这一方法进行功能验证。
付偲僮, 司未佳, 刘颖, 程堂仁, 王佳, 张启翔, 潘会堂. TRV介导的小报春基因沉默技术体系的建立[J]. 生物技术通报, 2022, 38(4): 295-302.
FU Si-tong, SI Wei-jia, LIU Ying, CHENG Tang-ren, WANG Jia, ZHANG Qi-xiang, PAN Hui-tang. Establishing Tobacco Rattle Virus-mediated Gene Silencing System for Primula forbesii[J]. Biotechnology Bulletin, 2022, 38(4): 295-302.
| 处理编号 No. | 菌液浓度 OD600 | 侵染液配方 Formula of infiltration liquid |
|---|---|---|
| 1 | 0.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 2 | 0.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 3 | 0.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 4 | 0.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 5 | 1.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 6 | 1.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 7 | 1.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5ml/L Tween 20 |
| 8 | 1.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5ml/L Tween 20 |
| 9 | 1.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 10 | 1.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 11 | 1.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 12 | 1.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 13 | 2.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 14 | 2.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 15 | 2.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 16 | 2.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
表1 侵染液菌液浓度及配方
Table 1 OD600 value and combinations of infiltration liquid
| 处理编号 No. | 菌液浓度 OD600 | 侵染液配方 Formula of infiltration liquid |
|---|---|---|
| 1 | 0.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 2 | 0.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 3 | 0.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 4 | 0.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 5 | 1.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 6 | 1.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 7 | 1.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5ml/L Tween 20 |
| 8 | 1.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5ml/L Tween 20 |
| 9 | 1.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 10 | 1.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 11 | 1.5 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 12 | 1.5 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 13 | 2.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 14 | 2.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES |
| 15 | 2.0 | 200 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 16 | 2.0 | 400 μmol/L AS+10 mmol/L MgCl2+10 mmol/L MES+400 cysteine+5 mL/L Tween 20 |
| 引物名称 Primer name | 序列 Sequence(5'-3') | 用途 Purpose |
|---|---|---|
| TRV1-F | TTACAGGTTATTTGGGCTAG | 病毒载体检测 Virus vector detection |
| TRV1-R | CCGGGTTCAATTCCTTATC | |
| TRV2-F | TGTTTGAGGGAAAAGTAG- AGAACGT | 病毒载体检测 Virus vector detection |
| TRV2-R | TTACCGATCAATCAAGAT- CAGTCGA | |
| PfPDS F | CTGCACATTTGGGTAAG | qRT-PCR |
| PfPDS-R | TGTCTTAGGTGGAAAGG |
表2 病毒载体检测及表达量检测引物
Table 2 Primers for viral vector detection and gene expre-ssion level detection
| 引物名称 Primer name | 序列 Sequence(5'-3') | 用途 Purpose |
|---|---|---|
| TRV1-F | TTACAGGTTATTTGGGCTAG | 病毒载体检测 Virus vector detection |
| TRV1-R | CCGGGTTCAATTCCTTATC | |
| TRV2-F | TGTTTGAGGGAAAAGTAG- AGAACGT | 病毒载体检测 Virus vector detection |
| TRV2-R | TTACCGATCAATCAAGAT- CAGTCGA | |
| PfPDS F | CTGCACATTTGGGTAAG | qRT-PCR |
| PfPDS-R | TGTCTTAGGTGGAAAGG |

图2 注射法侵染小报春后PDS基因沉默效果 A:对照;B:TRV2空载组;C:叶背注射PDS基因;D:叶柄注射PDS基因
Fig. 2 Silencing effect of PDS gene infection in P. forbesii A:CK. B:Empty TRV2 vector. C:Inject PDS gene at the back of leaf. D:Inject PDS gene at petiole

图3 PfPDS沉默后小报春的白化现象 A:PfPDS沉默后小报春整株白化现象;B:PfPDS沉默后小报春各部位白化现象
Fig.3 Whole plant albino after PfPDS gene silenced in P. forbessii A:Whole plant albinism after PfPDS gene silenced in P. forbessii. B:Albinism of all part after PfPDS gene silenced in P. forbessii vacuum infiltration

图4 真空渗透法侵染小报春后PDS基因的沉默效果 A:种子萌发长出下胚轴阶段;B:种子萌发长出子叶阶段;C:真空渗透侵染后叶片的表型变化
Fig. 4 Silencing effect of PDS gene in P. forbesii infected by vacuum infiltration method A:Stage of hypocotyl growth. B:Stage of cotyledon growth. C:Phenotypic changes of leaves infected by vacuum infiltration
| 处理时期 Time of treatment | 处理条件Condition of treatment | 侵染效率 Infection efficiency/% | |
|---|---|---|---|
| 压强 Pressure/kpa | 侵染时间 Infection time | ||
| 刚伸出胚轴的种子 | -25 | 30 s | 5 |
| 刚伸出胚轴的种子 | -25 | 2 min | 10 |
| 刚伸出胚轴的种子 | -25 | 5 min | 10 |
| 刚伸出胚轴的种子 | -50 | 30 s | 0 |
| 刚伸出胚轴的种子 | -50 | 2 min | 0 |
| 刚伸出胚轴的种子 | -50 | 5 min | 10 |
| 刚伸出胚轴的种子 | -75 | 30 s | 0 |
| 刚伸出胚轴的种子 | -75 | 2 min | 5 |
| 刚伸出胚轴的种子 | -75 | 5 min | 5 |
| 两片子叶的幼苗 | -25 | 30 s | 30 |
| 两片子叶的幼苗 | -25 | 2 min | 40 |
| 两片子叶的幼苗 | -25 | 5 min | 40 |
| 两片子叶的幼苗 | -50 | 30 s | 25 |
| 两片子叶的幼苗 | -50 | 2 min | 5 |
| 两片子叶的幼苗 | -50 | 5 min | 5 |
| 两片子叶的幼苗 | -75 | 30 s | 55 |
| 两片子叶的幼苗 | -75 | 2 min | 40 |
| 两片子叶的幼苗 | -75 | 5 min | 45 |
表3 真空渗透法侵染小报春萌发种子和带子叶幼苗的效果
Table 3 Infection efficiency on P. forbesii when seeds with hypocotyl and cotyledons infected by vacuum infiltration
| 处理时期 Time of treatment | 处理条件Condition of treatment | 侵染效率 Infection efficiency/% | |
|---|---|---|---|
| 压强 Pressure/kpa | 侵染时间 Infection time | ||
| 刚伸出胚轴的种子 | -25 | 30 s | 5 |
| 刚伸出胚轴的种子 | -25 | 2 min | 10 |
| 刚伸出胚轴的种子 | -25 | 5 min | 10 |
| 刚伸出胚轴的种子 | -50 | 30 s | 0 |
| 刚伸出胚轴的种子 | -50 | 2 min | 0 |
| 刚伸出胚轴的种子 | -50 | 5 min | 10 |
| 刚伸出胚轴的种子 | -75 | 30 s | 0 |
| 刚伸出胚轴的种子 | -75 | 2 min | 5 |
| 刚伸出胚轴的种子 | -75 | 5 min | 5 |
| 两片子叶的幼苗 | -25 | 30 s | 30 |
| 两片子叶的幼苗 | -25 | 2 min | 40 |
| 两片子叶的幼苗 | -25 | 5 min | 40 |
| 两片子叶的幼苗 | -50 | 30 s | 25 |
| 两片子叶的幼苗 | -50 | 2 min | 5 |
| 两片子叶的幼苗 | -50 | 5 min | 5 |
| 两片子叶的幼苗 | -75 | 30 s | 55 |
| 两片子叶的幼苗 | -75 | 2 min | 40 |
| 两片子叶的幼苗 | -75 | 5 min | 45 |
| 处理编号No. | 侵染效率Infection efficiency/% | 处理编号No. | 侵染效率Infection efficiency/% | |
|---|---|---|---|---|
| 1 | 40 | 9 | 0 | |
| 2 | 0 | 10 | 20 | |
| 3 | 0 | 11 | 0 | |
| 4 | 0 | 12 | 40 | |
| 5 | 20 | 13 | 0 | |
| 6 | 0 | 14 | 0 | |
| 7 | 20 | 15 | 0 | |
| 8 | 0 | 16 | 0 |
表4 不同OD600与侵染液配方侵染小报春的效率
Table 4 Infection efficiency of different OD600 values and different formula of infiltration liquid on P. forbesii
| 处理编号No. | 侵染效率Infection efficiency/% | 处理编号No. | 侵染效率Infection efficiency/% | |
|---|---|---|---|---|
| 1 | 40 | 9 | 0 | |
| 2 | 0 | 10 | 20 | |
| 3 | 0 | 11 | 0 | |
| 4 | 0 | 12 | 40 | |
| 5 | 20 | 13 | 0 | |
| 6 | 0 | 14 | 0 | |
| 7 | 20 | 15 | 0 | |
| 8 | 0 | 16 | 0 |
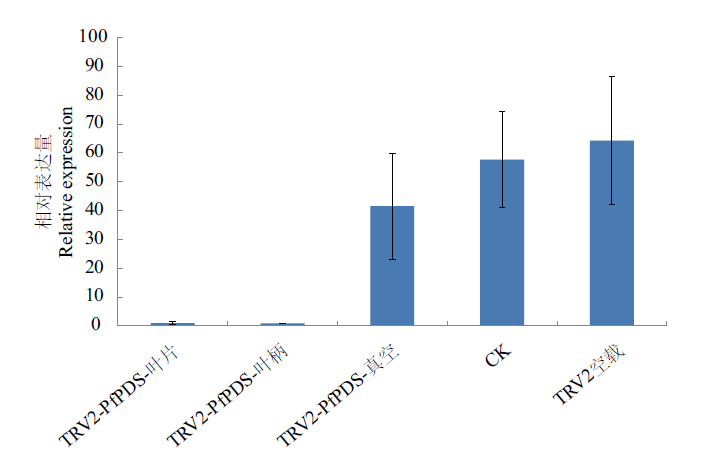
图6 使用不同方法基因沉默后小报春PDS基因的表达量检测 TRV2-PfPDS-叶片:叶背注射法得到的白化植株;TRV2-PfPDS-叶柄:叶柄注射法得到的白化植株;TRV2-PfPDS-真空:真空渗透法得到的白化植株
Fig.6 Detection results of PDS gene expression after gene silencing by different methods TRV2-PfPDS-leaf:Albino plant obtained by injection at the back of leaf. TRV2-PfPDS-petiole:Albino plant obtained by injection at petiole. TRV2-PfPDS-vacuum:Albino plant obtained by vacuum infiltration
| [1] |
Lu R, Martin-Hernandez AM, Peart JR, et al. Virus-induced gene silencing in plants[J]. Methods, 2003, 30(4):296-303.
doi: 10.1016/S1046-2023(03)00037-9 URL |
| [2] |
Xu P, Zhang YJ, Kang L, et al. Computational estimation and experimental verification of off-target silencing during posttranscriptional gene silencing in plants[J]. Plant Physiol, 2006, 142(2):429-440.
doi: 10.1104/pp.106.083295 URL |
| [3] | 傅达奇. 植物中病毒诱导基因沉默技术操作指导[M]. 北京: 中国农业大学出版社, 2016. |
| Fu DQ. Operation guidance of virus induced gene silencing in plants[M]. Beijing: China Agricultural University Press, 2006. | |
| [4] |
Liu Y, Schiff M, Dinesh-Kumar SP. Virus-induced gene silencing in tomato[J]. Plant J, 2002, 31(6):777-786.
doi: 10.1046/j.1365-313X.2002.01394.x URL |
| [5] |
Ratcliff F, Martin-Hernandez AM, Baulcombe DC. Technical advance. Tobacco rattle virus as a vector for analysis of gene function by silencing[J]. Plant J, 2001, 25(2):237-245.
pmid: 11169199 |
| [6] | Chung E, Seong E, Kim YC, et al. A method of high frequency virus-induced gene silencing in chili pepper(Capsicum annuum L. cv. Bukang)[J]. Mol Cells, 2004, 17(2):377-380. |
| [7] | Zhao Z, Luo Z, Yuan S, et al. Global transcriptome and gene co-expression network analyses on the development of distyly in Primula oreodoxa[J]. Heredity:Edinb, 2019, 123(6):784-794. |
| [8] |
Hayta S, Smedley MA, Li JH, et al. Plant regeneration from leaf-derived callus cultures of primrose(Primula vulgaris)[J]. HortScience, 2016, 51(5):558-562.
doi: 10.21273/HORTSCI.51.5.558 URL |
| [9] |
Hayta S, Smedley MA, Li J, et al. Agrobacterium-mediated transformation systems of Primula vulgaris[J]. Plant Methods, 2018, 14:93.
doi: 10.1186/s13007-018-0360-1 URL |
| [10] | 温小红, 姜永华, 周轲, 等. VIGS诱导MdHB-1沉默对苹果果实成熟的影响[J]. 西北农业学报, 2015, 24(11):113-119. |
| Wen XH, Jiang YH, Zhou K, et al. Effects of virus-induced MdHB-1 silencing on apple fruit ripening[J]. Acta Agric Boreali Occidentalis Sin, 2015, 24(11):113-119. | |
| [11] | 李聪聪, 安晓晖, 张中起, 等. 玉米TRV-VIGS的优化与顶腐病抗病基因的鉴定[J]. 核农学报, 2019, 33(11):2111-2118. |
| Li CC, An XH, Zhang ZQ, et al. Optimization of TRV-VIGS system and identification of top rot resistance related genes in maize[J]. J Nucl Agric Sci, 2019, 33(11):2111-2118. | |
| [12] | 李月, 吾尕力汗·阿不都维力, 周垚均, 等. 陆地棉小GTP结合蛋白基因GhRop4的克隆及其表达分析[J]. 棉花学报, 2020, 32(1):21-29. |
| Li Y, Wugalihan Abuduweili, Zhou YJ, et al. Molecular cloning and expression analysis of a small GTP-binding protein gene GhRop4 in Gossypium hirsutum L[J]. Cotton Sci, 2020, 32(1):21-29. | |
| [13] | 杨波, 刘海霞, 牛铁泉, 等. TRV介导的葡萄叶片VvANR基因瞬时表达分析[J]. 核农学报, 2021, 35(4):826-836. |
| Yang B, Liu HX, Niu TQ, et al. Transient expression analysis of VvANR gene in grape leaves mediated by TRV[J]. J Nucl Agric Sci, 2021, 35(4):826-836. | |
| [14] |
Zhang J, Yu D, Zhang Y, et al. Vacuum and co-cultivation agroinfiltration of(germinated)seeds results in tobacco rattle virus(TRV)mediated whole-plant virus-induced gene silencing(VIGS)in wheat and maize[J]. Front Plant Sci, 2017, 8:393.
doi: 10.3389/fpls.2017.00393 pmid: 28382049 |
| [15] | Zhang J, Tian J, Tai DQ, et al. An optimized TRV-based virus-induced gene silencing protocol for Malus crabapple[J]. Plant Cell Tissue Organ Cult PCTOC, 2016, 126(3):499-509. |
| [16] | 丁榕, 梁晶, 赵和文, 等. VIGS实验技术体系在月季中的应用及优化[J]. 中国农学通报, 2018, 34(3):87-92. |
| Ding R, Liang J, Zhao HW, et al. Application and optimization of VIGS experimental technology system in Rosa hybrida[J]. Chin Agric Sci Bull, 2018, 34(3):87-92. | |
| [17] |
Fantini E, Falcone G, Frusciante S, et al. Dissection of tomato lycopene biosynjournal through virus-induced gene silencing[J]. Plant Physiol, 2013, 163(2):986-998.
doi: 10.1104/pp.113.224733 pmid: 24014574 |
| [18] |
Fu DQ, Zhu BZ, Zhu HL, et al. Virus-induced gene silencing in tomato fruit[J]. Plant J, 2005, 43(2):299-308.
doi: 10.1111/j.1365-313X.2005.02441.x URL |
| [19] | 王旭, 王新果, 张朝贤, 等. 刺萼龙葵PDS基因VIGS载体的构建[J]. 植物保护, 2016, 42(4):137-141. |
| Wang X, Wang XG, Zhang CX, et al. VIGS vector construction of PDS gene in Solanum rostratum[J]. Plant Prot, 2016, 42(4):137-141. | |
| [20] | 陈峥, 辛丽琴, 吴超群, 等. VIGS技术在观赏植物中应用的研究进展[J]. 北方园艺, 2016(13):196-201. |
| Chen Z, Xin LQ, Wu CQ, et al. Advance in applications of virus-induced gene silencing(VIGS)technology to ornamental plants[J]. North Hortic, 2016(13):196-201. | |
| [21] | 侯文倩. 小麦赤霉病抗病相关基因的分离鉴定及BSMV-VIGS功能验证[D]. 泰安:山东农业大学, 2014. |
| Hou WQ. Identification and BSMV-VIGS analysis of candidate genes resistant to Fusarium head blight[D]. Tai’an:Shandong Agricultural University, 2014. | |
| [22] | 马红珍. 番茄VIGS体系构建及在番茄白粉病抗性研究上的应用[D]. 开封:河南大学, 2010. |
| Ma HZ. The establishment of tomato VIGS system and its application in decoding tomato powdery mildew resistance[D]. Kaifeng:Henan University, 2010. | |
| [23] | 闵德栋, 张新华, 季娜娜, 等. TRV介导的VIGS技术在果蔬基因功能研究中的应用[J]. 植物生理学报, 2017, 53(2):159-166. |
| Min DD, Zhang XH, Ji NN, et al. The application of TRV-mediated VIGS technique in the study of gene function in fruits and vegetables[J]. Plant Physiol J, 2017, 53(2):159-166. |
| [1] | 刘珍银, 段郅臻, 彭婷, 王童欣, 王健. 基于三角梅的病毒诱导基因沉默体系的建立与优化[J]. 生物技术通报, 2023, 39(7): 123-130. |
| [2] | 李文辰, 刘鑫, 康越, 李伟, 齐泽铮, 于璐, 王芳. TRV病毒诱导大豆基因沉默体系优化及应用[J]. 生物技术通报, 2023, 39(7): 143-150. |
| [3] | 刘思佳, 王浩楠, 付宇辰, 闫文欣, 胡增辉, 冷平生. ‘西伯利亚’百合LiCMK基因克隆及功能分析[J]. 生物技术通报, 2023, 39(3): 196-205. |
| [4] | 李秀青, 胡子曜, 雷建峰, 代培红, 刘超, 邓嘉辉, 刘敏, 孙玲, 刘晓东, 李月. 棉花黄萎病抗性相关基因GhTIFY9的克隆与功能分析[J]. 生物技术通报, 2022, 38(8): 127-134. |
| [5] | 高鹏飞, 席飞虎, 张泽宇, 胡凯强, 陈凯, 魏文桃, 丁家治, 顾连峰. 植物VIGS技术及其在林业科学中的研究进展[J]. 生物技术通报, 2021, 37(5): 141-153. |
| [6] | 雷朝霞, 刘晶, 白易平, 唐唯, 王洪洋. 马铃薯泛素结合酶基因StUBC17的克隆与功能分析[J]. 生物技术通报, 2019, 35(1): 35-41. |
| [7] | 苏子敬, 李巧玲, 黄程, 谢成建, 杨星勇. RNAi技术及其在真菌基因功能研究中的应用[J]. 生物技术通报, 2015, 31(8): 50-58. |
| [8] | 孙威,许奕,许桂莺,孙佩光,宋顺,常胜合. 病毒诱导的基因沉默及其在植物研究中的应用[J]. 生物技术通报, 2015, 31(10): 105-110. |
| [9] | 张献贺, 孔稳稳, 李勇, 李晶. 人工miRNA沉默基因的研究[J]. 生物技术通报, 2014, 0(4): 50-56. |
| [10] | 曹腾威,谷凌云,黄和,高振,郦明芳. 哺乳动物中RNA干扰沉默基因表达的研究进展[J]. 生物技术通报, 2014, 0(11): 24-31. |
| [11] | 张召军,王晓彬,王慧,刘林,张心阁,何秀霞. 中国番茄黄化曲叶病毒利用根吸收法诱导基因沉默(VIGS)的初步研究[J]. 生物技术通报, 2014, 0(1): 143-146. |
| [12] | 吴雪,袁金铎,赵楠楠,杨桂文,安利国. 涡虫的基因沉默作用[J]. 生物技术通报, 2013, 0(3): 24-29. |
| [13] | 王婷婷,王丹丹,Rahman Laibi Chelab,康丹,游腾飞,眭安平,杨星勇. RNA干扰及其在植物研究中的应用[J]. 生物技术通报, 2013, 0(3): 48-52. |
| [14] | 于定群, 汤浩茹, 张勇, 陈清, 张晓楠, 余昊唯. RNA干扰及其在果树上的应用[J]. 生物技术通报, 2012, 0(12): 57-64. |
| [15] | 李良德;刘婕;姜春来;赖先文;. 昆虫RNAi效率的影响因素研究进展[J]. , 2012, 0(11): 38-42. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||