







生物技术通报 ›› 2023, Vol. 39 ›› Issue (6): 133-140.doi: 10.13560/j.cnki.biotech.bull.1985.2022-1191
朱少喜1,2( ), 金肇阳1,2, 葛建镕2, 王蕊2, 王凤格2(
), 金肇阳1,2, 葛建镕2, 王蕊2, 王凤格2( ), 路运才1(
), 路运才1( )
)
收稿日期:2022-09-26
出版日期:2023-06-26
发布日期:2023-07-07
通讯作者:
路运才,男,博士,教授,研究方向:玉米种质资源创新与利用;E-mail: luyuncai@hlju.edu.cn;作者简介:朱少喜,硕士研究生,研究方向:玉米分子鉴定;E-mail: zhushaoxi0501@163.com;金肇阳为本文共同第一作者金肇阳为本文共同第一作者
基金资助:
ZHU Shao-xi1,2( ), JIN Zhao-yang1,2, GE Jian-rong2, WANG Rui2, WANG Feng-ge2(
), JIN Zhao-yang1,2, GE Jian-rong2, WANG Rui2, WANG Feng-ge2( ), LU Yun-cai1(
), LU Yun-cai1( )
)
Received:2022-09-26
Published:2023-06-26
Online:2023-07-07
摘要:
为了促进转基因玉米产业化发展,加快优良性状转化体与骨干自交系的转育工作,适用于回交群体的高通量前景选择方法亟待开发。本研究以转基因玉米DBN9936为材料,根据其外源插入片段及其侧翼序列,采用primer5软件设计了6对特异性引物,与内标准基因zSSIIb引物进行组合用于评估,获得最优引物组合后,进一步开展特异性验证、检出限测试和多样品验证。结果显示,最优引物组合为DBN9936-LB1*zSSIIb-k1;10份DBN9936 BC1代种子的 KASP基因分型结果与琼脂糖凝胶电泳结果完全一致;10份转化体DBN9858、DBN9501、C0010.1.3、C0010.3.1、C0010.3.7、C0030.2.5、BT11、GA21、MIR162和2A-7的转基因玉米样品在双平台上检测结果均表现为阴性;转基因玉米DBN9936的检出限为10%;48份不同DBN9936杂交种材料的KASP基因分型结果均表现为阳性。综上,本研究方法可用于转基因玉米DBN9936回交转育过程中的前景选择,且样品通量高,为其他农作物在转基因育种过程中的目标基因检测提供了技术参考。
朱少喜, 金肇阳, 葛建镕, 王蕊, 王凤格, 路运才. 基于KASP平台的转基因玉米高通量特异性检测方法[J]. 生物技术通报, 2023, 39(6): 133-140.
ZHU Shao-xi, JIN Zhao-yang, GE Jian-rong, WANG Rui, WANG Feng-ge, LU Yun-cai. High-throughput Specific Detection Methods for Transgenic Maize Based on the KASP Platform[J]. Biotechnology Bulletin, 2023, 39(6): 133-140.
| 编号No. | 核苷酸序列Nucleotide sequence |
|---|---|
| SEQ NO. ID 3 | 661 CCGCCGTATC TCCCGCCTCT CGCGCGCCAT CTCCCACACG CCGCCGCCGA 711 TCCTCTCTCTC GTCCTACGC CCACGAATGG CTCTCCAGCT GGAGAAAACC 761 GGCGGCCAGT GGATCCACCA TCAGGGGCAA GAAAACATCC CAAAACGCTA 811 GGCTCATGGG CACACAAGAC ACATTGTGGT GTAAACAAAT TGACGCTTAG 861 ACAACTTAAT AACACATTGC GGATACGGCC ATGCTGGCCG CCCCGCGCCG 911 ATCTAGTAAC ATAGATGACA CCGCGCGCGA TAATTTATCC TAGTTTGCGC 961 GCTATATTTT GTTTTCTATC GCGTATTAAA TGTATAATTG CGGGACTCTA |
| SEQ NO. ID 4 | 8001 TACATTAAAA ACGTCCGCAA TGTGTTATTA AGTTGTCTAA GCGTCAATTG 8051 GATCCCGTGG TCCCGGTCCC GTTTAAACCT AATCAGTCAG TGCCGGTGAG 8101 AGCGTAGCTG CCTGGAAGCG GCCTCGTCAG CCAACACCGT GAGGCTAGTG 8151 CCATCAATAA GTTATCAGTC AAACGGTCC GTTTAAACTA TCAGTGTTTG 8201 AAAGCGAGGC GAGGCGATGG GCGCGCGCGC GGGTCTCCTT TCCTGTTTCC 8251 TATTTGCACG CCCCTCAGCA CAGTAGTACA AGACGATTAT TATTTTTAAA 8301 CAATTGGATC AAGATGAGGC GGGGGGGTTG GGGGGCACTC ACTTGACCGC |
表1 DBN9936边界序列SEQ NO.ID 3和SEQ NO.ID 4
Table1 DBN9936 border sequences SEQ NO.ID 3 and SEQ NO.ID 4
| 编号No. | 核苷酸序列Nucleotide sequence |
|---|---|
| SEQ NO. ID 3 | 661 CCGCCGTATC TCCCGCCTCT CGCGCGCCAT CTCCCACACG CCGCCGCCGA 711 TCCTCTCTCTC GTCCTACGC CCACGAATGG CTCTCCAGCT GGAGAAAACC 761 GGCGGCCAGT GGATCCACCA TCAGGGGCAA GAAAACATCC CAAAACGCTA 811 GGCTCATGGG CACACAAGAC ACATTGTGGT GTAAACAAAT TGACGCTTAG 861 ACAACTTAAT AACACATTGC GGATACGGCC ATGCTGGCCG CCCCGCGCCG 911 ATCTAGTAAC ATAGATGACA CCGCGCGCGA TAATTTATCC TAGTTTGCGC 961 GCTATATTTT GTTTTCTATC GCGTATTAAA TGTATAATTG CGGGACTCTA |
| SEQ NO. ID 4 | 8001 TACATTAAAA ACGTCCGCAA TGTGTTATTA AGTTGTCTAA GCGTCAATTG 8051 GATCCCGTGG TCCCGGTCCC GTTTAAACCT AATCAGTCAG TGCCGGTGAG 8101 AGCGTAGCTG CCTGGAAGCG GCCTCGTCAG CCAACACCGT GAGGCTAGTG 8151 CCATCAATAA GTTATCAGTC AAACGGTCC GTTTAAACTA TCAGTGTTTG 8201 AAAGCGAGGC GAGGCGATGG GCGCGCGCGC GGGTCTCCTT TCCTGTTTCC 8251 TATTTGCACG CCCCTCAGCA CAGTAGTACA AGACGATTAT TATTTTTAAA 8301 CAATTGGATC AAGATGAGGC GGGGGGGTTG GGGGGCACTC ACTTGACCGC |
| 引物名称 Primer name | 引物序列 Primer sequence(5'-3') | 产物长度 Product length/bp |
|---|---|---|
| zSSIIb-1F | CTCCCAATCCTTTGACATCTGC | 151 |
| zSSIIb-2R | TCGATTTCTCTCTTGGTGACAGG | |
| C0030.3.5-F | CTCGTCAGCCAACACCGTGA | 202 |
| C0030.3.5-R | CCCCGC CTCATCTTGATCCA |
表2 PCR引物名称和序列
Table2 PCR primer names and sequences
| 引物名称 Primer name | 引物序列 Primer sequence(5'-3') | 产物长度 Product length/bp |
|---|---|---|
| zSSIIb-1F | CTCCCAATCCTTTGACATCTGC | 151 |
| zSSIIb-2R | TCGATTTCTCTCTTGGTGACAGG | |
| C0030.3.5-F | CTCGTCAGCCAACACCGTGA | 202 |
| C0030.3.5-R | CCCCGC CTCATCTTGATCCA |
| 引物名称 Primer name | 引物序列 Primer sequence(5'-3') | 产物大小 Product size/bp |
|---|---|---|
| DBN9936-LB1 | F: FAM-CCACCATCAGGGGCAAGA | 84 |
| R: AAGCGTCAAATTTGTTTACACCAC | ||
| DBN9936-LB2 | F: FAM-GATCCACCATCAGGGGCAAGA R: CATGGCCGTATCCGCAATGTG | 122 |
| DBN9936-LB3 | F: FAM-CCACCATCAGGGGCAAGA R: AGCATGGCCGTATCCGCA | 121 |
| DBN9936-RB1 | F: FAM-CGTGAGGCTAGTGCCATCAAT R: AAACAGGAAAGGAGACCCGC | 110 |
| DBN9936-RB2 | F: FAM-CCAACACCGTGAGGCTAGTG R: AAACAGGAAAGGAGACCCGC | 117 |
| DBN9936-RB3 | F: FAM-CGTGAGGCTAGTGCCATCAA R: AGGGGCGTGCAAATAGGAAA | 121 |
| zSSIIb-k1 | F: HEX-CAAAGTCAGAGCGCTGCAATGCAAA R: CGCTGCTGCCCCCACTCGTT | 74 |
| zSSIIb-k2 | F: HEX-CCTTTGACATCTGCTCCGAAGCAAA R: CAGGAGCTGATGGATGATCAGCTTT | 119 |
表3 KASP引物名称和序列
Table3 KASP primer names and sequences
| 引物名称 Primer name | 引物序列 Primer sequence(5'-3') | 产物大小 Product size/bp |
|---|---|---|
| DBN9936-LB1 | F: FAM-CCACCATCAGGGGCAAGA | 84 |
| R: AAGCGTCAAATTTGTTTACACCAC | ||
| DBN9936-LB2 | F: FAM-GATCCACCATCAGGGGCAAGA R: CATGGCCGTATCCGCAATGTG | 122 |
| DBN9936-LB3 | F: FAM-CCACCATCAGGGGCAAGA R: AGCATGGCCGTATCCGCA | 121 |
| DBN9936-RB1 | F: FAM-CGTGAGGCTAGTGCCATCAAT R: AAACAGGAAAGGAGACCCGC | 110 |
| DBN9936-RB2 | F: FAM-CCAACACCGTGAGGCTAGTG R: AAACAGGAAAGGAGACCCGC | 117 |
| DBN9936-RB3 | F: FAM-CGTGAGGCTAGTGCCATCAA R: AGGGGCGTGCAAATAGGAAA | 121 |
| zSSIIb-k1 | F: HEX-CAAAGTCAGAGCGCTGCAATGCAAA R: CGCTGCTGCCCCCACTCGTT | 74 |
| zSSIIb-k2 | F: HEX-CCTTTGACATCTGCTCCGAAGCAAA R: CAGGAGCTGATGGATGATCAGCTTT | 119 |

图1 引物单独扩增分型结果 A:DBN9936-LB1引物单独扩增扫描结果;B:DBN9936-RB1引物单独扩增扫描结果;C:DBN9936-RB2引物单独扩增扫描结果;D:DBN9936-RB3引物单独扩增扫描结果;E:DBN9936-LB2引物单独扩增扫描结果;F:DBN9936-LB3引物单独扩增扫描结果。图中每1点代表1份样品的检测结果。向上箭头的点代表DBN9936标准品,向下箭头的点代表京科968。蓝色点:阳性纯合基因型;红色点:阴性纯合基因型;黑色点:NTC。下同
Fig. 1 Results of single primer amplification typing A: The scan results of single primer amplification of DBN9936-LB1; B: the scan results of single primer amplification of DBN9936-RB1; C: the scan results of single primer amplification of DBN9936-RB2; D: the scan results of single primer amplification of DBN9936-RB3; E: the scan results of single primer amplification of DBN9936-LB2; F: the scan results of single primer amplification of DBN9936-LB3. Each point in the figure indicates the test results of one sample. The dots of the upward arrow indicate the DBN9936 standard, and the dots of the downward arrow indicate Jingke 968. Blue dots: positive homozygous genotypes; red dots: negative homozygous genotypes; black dots: NTC. The same below

图2 引物复合扩增分型结果 A:引物DBN9936-LB1*zSSIIb-k1的复合扩增扫描结果;B: DBN9936-LB1*zSSIIb-k2的复合扩增扫描结果。绿色点:杂合基因型。下同
Fig. 2 Composite primer amplification typing results A: The composite amplification scan results of primer DBN9936-LB1 * zSSIIb-k1; B: the composite amplification scan results of primer DBN9936-LB1 * zSSIIb-k2. Green dots: Heterozygous genotypes. The same below

图3 目标基因检测分型图 圆点代表DBN9936回交BC1样品;10个右半圆点代表含有转化体(DBN9858、DBN9501、C0010.1.3、C0010.3.1、C0010.3.7、C0030.2.5、BT11、GA21、MIR162和2A-7)的转基因玉米
Fig. 3 Target gene detection genotyping map The cycle dots indicates the BC1 sample. The 10 right semicircle dots indicate transgenic maize samples containing transformants(DBN9858, DBN9501, C0010.1.3, C0010.3.1, C0010.3.7, C0030.2.5, BT11, GA21, MIR162 and 2A-7)
| 样品 Sample | KASP检测结果 Results of KASP detection | 普通PCR检测结果 Results of ordinary PCR detection |
|---|---|---|
| 1 | - | - |
| 2 | + | + |
| 3 | + | + |
| 4 | + | + |
| 5 | + | + |
| 6 | + | + |
| 7 | - | - |
| 8 | + | + |
| 9 | - | - |
| 10 | + | + |
| 11 | - | - |
| 12 | - | - |
| 13 | - | - |
| 14 | - | - |
| 15 | - | - |
| 16 | - | - |
| 17 | - | - |
| 18 | - | - |
| 19 | - | - |
| 20 | - | - |
表4 双平台检测结果对比
Table 4 Comparison of double platform detection results
| 样品 Sample | KASP检测结果 Results of KASP detection | 普通PCR检测结果 Results of ordinary PCR detection |
|---|---|---|
| 1 | - | - |
| 2 | + | + |
| 3 | + | + |
| 4 | + | + |
| 5 | + | + |
| 6 | + | + |
| 7 | - | - |
| 8 | + | + |
| 9 | - | - |
| 10 | + | + |
| 11 | - | - |
| 12 | - | - |
| 13 | - | - |
| 14 | - | - |
| 15 | - | - |
| 16 | - | - |
| 17 | - | - |
| 18 | - | - |
| 19 | - | - |
| 20 | - | - |
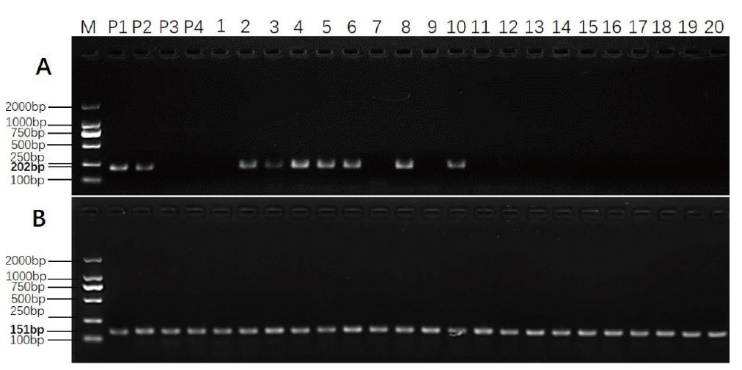
图4 PCR产物琼脂糖电泳检测结果 A:引物C003.3.5转化体特异性序列扩增产物条带;B:内标准基因引物zSSIIB的扩增产物条带。M:分子量标准;P1和P2:DBN9936标准品;P3和P4:京科968;1-10:10份DBN9936回交BC1样品;11-20:10份分别包含转化体(DBN9858、DBN9501、C0010.1.3、C0010.3.1、C0010.3.7、C0030.2.5、BT11、GA21、MIR162和2A-7)的转基因玉米
Fig. 4 Agarose electrophoresis results of PCR products A: The amplification product band of primer C003.3.5 transformant specific sequence; B: the amplification product band of the primer for internal standard gene zSSIIB. M: Molecular weight standard; P1 and P2: DBN9936 standard; P3 and P4: Jingke 968; 1-10: 10 DBN9936 backcross BC1 samples; 11-20: 10 transgenic maize containing transformants(DBN9858, DBN9501, C0010.1.3, C0010.3.1, C0010.3.7, C0030.2.5, BT11, GA21, MIR162 and 2A-7)
| [1] | 刘亚, 赵久然. 转基因玉米新种质创制若干技术环节的探讨[J]. 中国农业科技导报, 2011, 13(4): 46-52. |
| Liu Y, Zhao JR. Discussion about cetrtain technological links in creating new transgenic maize germplasm[J]. J Agric Sci Technol, 2011, 13(4): 46-52. | |
| [2] |
Holst-Jensen A. Testing for genetically modified organisms(GMOs): Past, present and future perspectives[J]. Biotechnol Adv, 2009, 27(6): 1071-1082.
doi: S0734-9750(09)00102-5 pmid: 19477261 |
| [3] | 孙珊珊, 王春生, 朱婷婷, 等. NPR1和Cry1Ab13-1基因双价植物表达载体的构建及在玉米中的转化[J]. 分子植物育种, 2022, 20(13): 4354-4362. |
| Sun SS, Wang CS, Zhu TT, et al. Construction of bivalent plant expressed vector of NPR1 and Cry1Ab13-1 genes and its transformation in maize[J]. Mol Plant Breed, 2022, 20(13): 4354-4362. | |
| [4] | 李瑞环, 刘双, 兰青阔, 等. 转基因耐除草剂大豆ZH10-6多重PCR检测方法的建立[J]. 农业生物技术学报, 2021, 29(8): 1640-1648. |
| Li RH, Liu S, Lan QK, et al. Establishment of multiplex PCR detection method for genetically modified herbicide tolerant soybean(Glycine max)ZH10-6[J]. J Agric Biotechnol, 2021, 29(8): 1640-1648. | |
| [5] | 龙丽坤, 赵宁, 李葱葱, 等. 转基因玉米CM8101实时荧光定量PCR检测方法的建立[J]. 农业生物技术学报, 2021, 29(5): 1007-1015. |
| Long LK, Zhao N, Li CC, et al. Establishment of RT-qPCR method of detection transgenic maize(Zea mays)CM8101[J]. J Agric Biotechnol, 2021, 29(5): 1007-1015. | |
| [6] | 董姗姗, 肖泽华, 章嫡妮, 等. 基于微滴式数字PCR定量检测转基因玉米‘CC-2’外源基因和内参基因在土壤中的存留[J]. 农业生物技术学报, 2022, 30(5): 1014-1022. |
| Dong SS, Xiao ZH, Zhang DN, et al. Quantitative detection of soil persistence of exogenous and reference gene from genetically modified maize(Zea mays)‘CC-2’ by droplet digital PCR[J]. J Agric Biotechnol, 2022, 30(5): 1014-1022. | |
| [7] | 周德龙, 孟令聪, 郑淑波, 等. 一种快速高效检测转基因玉米方法的建立[J]. 作物杂志, 2022(1): 65-69. |
| Zhou DL, Meng LC, Zheng SB, et al. Establishing of a fast and efficient testing method of transgenic maize[J]. Crops, 2022(1): 65-69. | |
| [8] | 吴金凤, 宋伟, 王蕊, 等. 利用SNP标记对51份玉米自交系进行类群划分[J]. 玉米科学, 2014, 22(5): 29-34. |
| Wu JF, Song W, Wang R, et al. Heterotic grouping of 51 maize inbred lines by SNP markers[J]. J Maize Sci, 2014, 22(5): 29-34. | |
| [9] |
盛小光, 沈钰森, 虞慧芳, 等. 花椰菜花球发育相关基因BoCAL的KASP标记开发和应用[J]. 浙江农业学报, 2022, 34(6): 1183-1192.
doi: 10.3969/j.issn.1004-1524.2022.06.09 |
| Sheng XG, Shen YS, Yu HF, et al. Development and application of KASP marker of BoCAL gene related to curd development in cauliflower[J]. Acta Agric Zhejiangensis, 2022, 34(6): 1183-1192. | |
| [10] |
杨双娟, 张晓伟, 魏小春, 等. 大白菜抗根肿病基因BraA.Pb.8.4的定位及KASP标记开发[J]. 园艺学报, 2021, 48(7): 1317-1328.
doi: 10.16420/j.issn.0513-353x.2020-0656 |
| Yang SJ, Zhang XW, Wei XC, et al. Mapping and KASP markers development for clubroot resistance gene BraA.Pb.8.4 in Chinese cabbage[J]. Acta Hortic Sin, 2021, 48(7): 1317-1328. | |
| [11] | 梁紫越, 刘志浩, 马世鹏, 等. 基于双平台的InDel标记玉米杂交种纯度鉴定方法[J]. 玉米科学, 2022, 30(3): 32-39. |
| Liang ZY, Liu ZH, Ma SP, et al. Using indel markers for purity identification method of hybrid seeds in maize based on dual platforms[J]. J Maize Sci, 2022, 30(3): 32-39. | |
| [12] | 任佳丽. 转基因玉米标准物质-质粒阳性物质构建与检测方法的建立[D]. 乌鲁木齐: 新疆农业大学, 2021. |
| Ren JL. Construction of transgenic maize standard substance-plasmid positive substance and establishment of detection method for transgenic maize[D]. Urumqi: Xinjiang Agricultural University, 2021. | |
| [13] | 丁德荣, 康越景, 张云珠, 等. 用于检测玉米植物DBN9936的核酸序列及其检测方法: CN104830847B[P]. 2019-01-11. |
| Ding DR, Kang YJ, Zhang YZ, et al. Nucleic acid sequence for detecting corn plant DBN9936, and detection method thereof: CN104830847B[P]. 2019-01-11. | |
| [14] |
Rasheed A, Wen WE, Gao FM, et al. Development and validation of KASP assays for genes underpinning key economic traits in bread wheat[J]. Theor Appl Genet, 2016, 129(10): 1843-1860.
doi: 10.1007/s00122-016-2743-x pmid: 27306516 |
| [15] | 中华人民共和国农业部. 转基因植物及其产品成分检测玉米内标准基因定性PCR方法: 农业部1861号公告-3—2012[S]. 北京: 中国农业出版社, 2013. |
| Ministry of Agriculture of the People's Republic of China. Detection of genetically modified plants and derived products. Target-taxon-specifis qualitative PCR method for maize: Ministry of Agriculture Proclamation No1861-3—2012[S]. Beijing: Chinese Agriculture Press, 2013. | |
| [16] | 中华人民共和国农业部.转基因植物及其产品成分检测抗虫耐除草剂玉米C0030.3.5及其衍生品种定性PCR方法: 农业部2630号公告-9—2017[S]. 北京: 中国农业出版社, 2017. |
| Ministry of agriculture of the People's Republic of China. Detection of genetically modified plants and derived products Qualitative PCR method for insect resistant and herbicide-tolerant maize C0030.3.5 and its derivates:Ministry of Agriculture Proclamation No.2630-9-2017[S]. Beijing: Chinese Agriculture Press, 2017. | |
| [17] | 沈平, 章秋艳, 林友华, 等. 推进我国转基因玉米产业化的思考[J]. 中国生物工程杂志, 2016, 36(4): 24-29. |
| Shen P, Zhang QY, Lin YH, et al. Thinking to promote the industrialization of genetically modified corn of our country[J]. China Biotechnol, 2016, 36(4): 24-29. | |
| [18] |
王蕊, 施龙建, 田红丽, 等. 玉米杂交种纯度鉴定SNP核心引物的确定及高通量检测方案的建立[J]. 作物学报, 2021, 47(4): 770-779.
doi: 10.3724/SP.J.1006.2021.03031 |
|
Wang R, Shi LJ, Tian HL, et al. Identification of SNP core primer and establishment of high throughput detection scheme for purity identification in maize hybrids[J]. Acta Agron Sin, 2021, 47(4): 770-779.
doi: 10.3724/SP.J.1006.2021.03031 |
|
| [19] |
杨青青, 唐家琪, 张昌泉, 等. KASP标记技术在主要农作物中的应用及展望[J]. 生物技术通报, 2022, 38(4): 58-71.
doi: 10.13560/j.cnki.biotech.bull.1985.2021-1378 |
| Yang QQ, Tang JQ, Zhang CQ, et al. Application and prospect of KASP marker technology in main crops[J]. Biotechnol Bull, 2022, 38(4): 58-71. | |
| [20] |
Yi HM, Liang ZY, Ge JR, et al. A multiplex PCR system for the screening of genetically modified(GM)maize and the detection of 29 GM maize events based on capillary electrophoresis[J]. Agriculture, 2022, 12(3): 413.
doi: 10.3390/agriculture12030413 URL |
| [21] | 郭燕风. 转基因玉米中外源基因检测方法的研究[D]. 泰安: 山东农业大学, 2011. |
| Guo YF. Study on the detection methods of exogenous gene in genetically modified maize[D]. Tai'an: Shandong Agricultural University, 2011. |
| [1] | 李圣彦, 李香银, 李鹏程, 张明俊, 张杰, 郎志宏. 转基因玉米2HVB5的性状鉴定及遗传稳定性分析[J]. 生物技术通报, 2023, 39(1): 21-30. |
| [2] | 李鹏程, 张明俊, 王银晓, 李香银, 李圣彦, 郎志宏. 转基因玉米HGK60在不同遗传背景下抗虫性鉴定及农艺性状分析[J]. 生物技术通报, 2023, 39(1): 40-47. |
| [3] | 焦悦, 韩宇, 杨桥, 黄耀辉, 安吉翠, 杨亚洲, 叶纪明. 全球转基因玉米商业化发展态势概述及启示[J]. 生物技术通报, 2021, 37(4): 164-176. |
| [4] | 温洪涛, 李夏莹, 杨洋, 陈子言, 丁一佳, 张秀杰, 张瑞英. 玉米转基因成分筛查策略[J]. 生物技术通报, 2020, 36(5): 39-47. |
| [5] | 王颢潜, 肖芳, 杨蕾, 缪青梅, 张旭冬, 张秀杰. 转基因玉米双抗12-5转化体特异性PCR方法验证结果分析[J]. 生物技术通报, 2020, 36(5): 48-55. |
| [6] | 杨镇州, 刘刚, 许丽. 基于RNAi技术的转基因玉米逆转录数字PCR检测方法[J]. 生物技术通报, 2020, 36(5): 56-63. |
| [7] | 李葱葱, 谢苹, 董立明, 夏蔚, 兰青阔, 闫伟, 龙丽坤, 李飞武. 抗虫耐除草剂玉米GH5112E-117C定性PCR检测方法[J]. 生物技术通报, 2020, 36(5): 64-67. |
| [8] | 王翠云, 刘艳, 刘允军. 外源基因在转基因玉米中的整合位点分析[J]. 生物技术通报, 2019, 35(3): 1-5. |
| [9] | 梁海生, 李梦桃, 李圣彦, 汪海, 张杰, 郎志宏. 转Bt基因抗虫玉米HGK60的农艺性状分析[J]. 生物技术通报, 2018, 34(7): 92-100. |
| [10] | 郑莹,刘家益,左璇,李圣彦,吴圣,聂凤英. 基于文献计量和内容挖掘的转基因玉米科研态势研究[J]. 生物技术通报, 2016, 32(12): 203-213. |
| [11] | 李欣竹, 耿丽丽, 高继国, 张杰. Cry1Ie蛋白的模拟胃肠液消化稳定性及热稳定性分析[J]. 生物技术通报, 2015, 31(11): 214-221. |
| [12] | 王建军,杨慧珍,刘佼. cryIAc基因在转基因玉米中的遗传规律及对抗虫性影响[J]. 生物技术通报, 2015, 31(1): 122-130. |
| [13] | 戴军, 李秀影, 朱莉, 汪海, 张杰, 何康来, 郎志宏, 黄大昉. 转Bt cry1Ah基因抗虫玉米的分子检测及农艺性状分析[J]. 生物技术通报, 2014, 0(5): 62-68. |
| [14] | 王宁. 基于文献计量分析我国转基因玉米研究现状[J]. 生物技术通报, 2014, 0(10): 230-234. |
| [15] | 程涛;王慧煜;黄新;余多慰;韩雪清;. 转基因玉米Bt176液相芯片检测方法的建立[J]. , 2012, 0(04): 158-164. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||