







生物技术通报 ›› 2024, Vol. 40 ›› Issue (6): 299-309.doi: 10.13560/j.cnki.biotech.bull.1985.2023-1215
杨鹭1,2( ), 袁源2, 方志锴2, 林如2, 江红1,2(
), 袁源2, 方志锴2, 林如2, 江红1,2( ), 周剑1,2(
), 周剑1,2( )
)
收稿日期:2023-12-25
出版日期:2024-06-26
发布日期:2024-05-15
通讯作者:
周剑,男,硕士,研究员,研究方向:微生物药物学;E-mail: zjian503@163.com;作者简介:杨鹭,女,硕士,研究方向:微生物药物学;E-mail: 1950302732@qq.com
基金资助:
YANG Lu1,2( ), YUAN Yuan2, FANG Zhi-kai2, LIN Ru2, JIANG Hong1,2(
), YUAN Yuan2, FANG Zhi-kai2, LIN Ru2, JIANG Hong1,2( ), ZHOU Jian1,2(
), ZHOU Jian1,2( )
)
Received:2023-12-25
Published:2024-06-26
Online:2024-05-15
摘要:
【目的】 对链霉菌Streptomyce sp. FIM18-0592进行菌种鉴定,并对其胞外格尔德霉素产量进行发酵工艺优化,旨在提高产量并降低发酵成本。【方法】 通过形态特征、培养特征和生理生化特性,结合16S rDNA序列分析构建系统发育树进行菌种鉴定;采用单因素试验优化培养条件及培养基配方,进一步使用最陡爬坡试验和响应面试验优化培养基配方的含量。【结果】 通过对链霉菌FIM18-0592的形态特征、培养特征及生理生化特征进行初步培养观察发现,其在ISP2等培养基上生长较好,气生菌丝旺盛,产黑色素。结合16S rDNA分子鉴定,确定该菌为格尔德霉素链霉菌(Streptomyces geldanamycininus)。通过单因素试验对发酵条件以及培养基配方进行优化,得到最适宜菌株发酵的培养条件为转速140 r/min、装液量12%(体积分数)、接种量7%(体积分数)、培养时间144 h。最佳的碳源、氮源、无机盐分别为葡萄糖、黄豆饼粉和硫酸铵。采用最陡爬坡试验和响应面优化试验确定了其最优的发酵培养基为:葡萄糖10.42%、黄豆饼粉1.68%、硫酸铵0.3%、乳酸0.3%、甘油4%、硫酸镁0.1%、碳酸钙0.4%,在此条件下,格尔德霉素的发酵效价达到2 887 μg/mL,较原始发酵工艺效价提高了66%。【结论】 链霉菌FIM18-0592为格尔德霉素链霉菌,通过对其发酵工艺进行优化显著提高格尔德霉素的产量,为格尔德霉素及其衍生物的开发和利用奠定基础。
杨鹭, 袁源, 方志锴, 林如, 江红, 周剑. 一株链霉菌的鉴定及其产格尔德霉素的发酵工艺研究[J]. 生物技术通报, 2024, 40(6): 299-309.
YANG Lu, YUAN Yuan, FANG Zhi-kai, LIN Ru, JIANG Hong, ZHOU Jian. Identification of a Streptomyces Strain and Study on the Fermentation Process of Geldanamycin Production[J]. Biotechnology Bulletin, 2024, 40(6): 299-309.
| 培养基类型 Type of culture medium | 培养基配方 Component of culture medium |
|---|---|
| 种子培养基Seed medium | 葡萄糖1.8%;麦芽糊精1.0%;黄豆饼粉2.25%;酵母粉0.5%;MgSO4·7H2O 0.1%;K2HPO4·3H2O 0.1%(pH 7.0) |
| 发酵培养基Fermentation medium | 淀粉4.0%;黄豆饼粉4.0%;氯化钴0.001%;豆油0.5%;碳酸钙1.0%(pH 7.2) |
| 胰蛋白胨-酵母膏琼脂ISP1 | 胰蛋白胨0.5%;酵母膏0.3%;琼脂2%(pH 7.0-7.4) |
| 酵母膏-麦芽膏琼脂ISP2 | 酵母膏0.4%;麦芽膏1%;葡萄糖0.4%;琼脂2%(pH 7.3) |
| 燕麦粉琼脂ISP3 | 燕麦粉2%;微盐0.1%;琼脂2%(pH 7.3) |
| 无机盐-淀粉琼脂ISP4 | 可溶性淀粉1%;K2HPO4·3H2O 0.1%;MgSO4·7H2O 0.1%;NaCl 0.1%;(NH4)2SO4 0.2%;CaCO3 0.2%;琼脂2% |
| 甘油-天冬酰胺琼脂ISP5 | L-天冬酰胺0.%;K2HPO4·3H2O 0.1%;甘油1%;微盐0.1%;琼脂2% |
| 蛋白胨酵母提取物铁琼脂ISP6 | Bacto蛋白胨铁琼脂3.6%;酵母膏0.1%(pH 7.0-7.2) |
| 酪氨酸琼脂ISP7 | 酵母膏0.1%;L-酪氨酸0.1%;NaCl 0.85%;琼脂2%(pH 7.5) |
| 高氏1号培养基G1 | 可溶性淀粉2%;KNO3 0.1%;K2HPO4·3H2O 0.05%;MgSO4·7H2O 0.05%;NaCl 0.05%;FeSO4 0.001%;琼脂2%(pH 7.2-7.4) |
| 马铃薯培养基PDA | 马铃薯20%;葡萄糖2%;琼脂2%(pH 6-6.5) |
| 蛋白胨-甘油培养基CM008 | 蛋白胨0.5%;牛肉提取物0.3%;甘油2%;琼脂1.5%(pH 7.0) |
| 葡萄糖-天门冬素培养基CM0011 | 葡萄糖1%;天门冬素0.05%;K2HPO4·3H2O 0.05%;琼脂1.5%(pH 7.2-7.4) |
| 查氏-蔗糖Charlery - sucrose | 蔗糖3%;K2HPO4·3H2O 0.1%;MgSO4·7H2O 0.05%;KCl 0.05%;NaNO3 0.2%;琼脂2%(pH 7.2-7.4) |
表1 培养基类型及配方
Table 1 Type and formula of medium
| 培养基类型 Type of culture medium | 培养基配方 Component of culture medium |
|---|---|
| 种子培养基Seed medium | 葡萄糖1.8%;麦芽糊精1.0%;黄豆饼粉2.25%;酵母粉0.5%;MgSO4·7H2O 0.1%;K2HPO4·3H2O 0.1%(pH 7.0) |
| 发酵培养基Fermentation medium | 淀粉4.0%;黄豆饼粉4.0%;氯化钴0.001%;豆油0.5%;碳酸钙1.0%(pH 7.2) |
| 胰蛋白胨-酵母膏琼脂ISP1 | 胰蛋白胨0.5%;酵母膏0.3%;琼脂2%(pH 7.0-7.4) |
| 酵母膏-麦芽膏琼脂ISP2 | 酵母膏0.4%;麦芽膏1%;葡萄糖0.4%;琼脂2%(pH 7.3) |
| 燕麦粉琼脂ISP3 | 燕麦粉2%;微盐0.1%;琼脂2%(pH 7.3) |
| 无机盐-淀粉琼脂ISP4 | 可溶性淀粉1%;K2HPO4·3H2O 0.1%;MgSO4·7H2O 0.1%;NaCl 0.1%;(NH4)2SO4 0.2%;CaCO3 0.2%;琼脂2% |
| 甘油-天冬酰胺琼脂ISP5 | L-天冬酰胺0.%;K2HPO4·3H2O 0.1%;甘油1%;微盐0.1%;琼脂2% |
| 蛋白胨酵母提取物铁琼脂ISP6 | Bacto蛋白胨铁琼脂3.6%;酵母膏0.1%(pH 7.0-7.2) |
| 酪氨酸琼脂ISP7 | 酵母膏0.1%;L-酪氨酸0.1%;NaCl 0.85%;琼脂2%(pH 7.5) |
| 高氏1号培养基G1 | 可溶性淀粉2%;KNO3 0.1%;K2HPO4·3H2O 0.05%;MgSO4·7H2O 0.05%;NaCl 0.05%;FeSO4 0.001%;琼脂2%(pH 7.2-7.4) |
| 马铃薯培养基PDA | 马铃薯20%;葡萄糖2%;琼脂2%(pH 6-6.5) |
| 蛋白胨-甘油培养基CM008 | 蛋白胨0.5%;牛肉提取物0.3%;甘油2%;琼脂1.5%(pH 7.0) |
| 葡萄糖-天门冬素培养基CM0011 | 葡萄糖1%;天门冬素0.05%;K2HPO4·3H2O 0.05%;琼脂1.5%(pH 7.2-7.4) |
| 查氏-蔗糖Charlery - sucrose | 蔗糖3%;K2HPO4·3H2O 0.1%;MgSO4·7H2O 0.05%;KCl 0.05%;NaNO3 0.2%;琼脂2%(pH 7.2-7.4) |
| 水平 Level | A:葡萄糖Glucose/(g·L-1) | B:黄豆饼粉Soybean cake powder/(g·L-1) | C:硫酸铵 (NH4)2SO4/(g·L-1) |
|---|---|---|---|
| -1 | 80 | 15 | 2.5 |
| 0 | 100 | 20 | 3.0 |
| 1 | 120 | 25 | 3.5 |
表2 格尔德霉素的优化的Box-Behnken试验因素与水平
Table 2 Optimized Box-Behnken test factors and levels via geldamycin
| 水平 Level | A:葡萄糖Glucose/(g·L-1) | B:黄豆饼粉Soybean cake powder/(g·L-1) | C:硫酸铵 (NH4)2SO4/(g·L-1) |
|---|---|---|---|
| -1 | 80 | 15 | 2.5 |
| 0 | 100 | 20 | 3.0 |
| 1 | 120 | 25 | 3.5 |
| 培养基 Medium | 生长状态 Growth state | 表面颜色 Surface color | 背面颜色 Back color | 气生菌丝 Aerial mycelium | 基质菌丝 Substrate mycelium | 产孢情况 Spore production situation | 可溶性色素 Soluble pigment | 质地 Texture |
|---|---|---|---|---|---|---|---|---|
| ISP1 | +++ | 绿白色 | 绿白色 | 浅绿灰色 | 绿白色 | 适中 | 无 | 圆形,波浪边缘,表面不光滑 |
| ISP2 | ++++ | 绿灰色 | 中等黄褐色 | 绿灰色 | 绿白色 | 较厚 | 有 | 圆形,波浪边缘,表面不光滑,较多褶皱 |
| ISP3 | ++++ | 绿灰色 | 浅绿灰色 | 绿灰色 | 绿白色 | 较厚 | 无 | 圆形,锯形边缘,表面不光滑 |
| ISP4 | ++++ | 灰黄绿 | 黄灰色 | 灰黄绿 | 绿白色 | 较厚 | 有 | 圆形,锯形边缘,表面不光滑 |
| ISP5 | ++++ | 浅绿灰色 | 绿白色 | 浅绿灰色 | 绿白色 | 较厚 | 无 | 圆形,锯形边缘,表面不光滑 |
| ISP6 | +++ | 绿白色 | 深黄色 | 绿白色 | 绿白色 | 较薄 | 无 | 圆形,波浪边缘,表面较光滑 |
| ISP7 | ++++ | 浅灰黄色 | 深黄褐色 | 浅灰黄色 | 浅灰黄色 | 适中 | 有 | 圆形,波浪边缘,表面光滑 |
| G1 | ++++ | 灰黄绿 | 浅绿灰色 | 灰黄绿 | 淡黄绿色 | 较厚 | 有 | 圆形,波浪边缘,表面光滑 |
| PDA | ++++ | 绿灰色 | 绿灰色 | 绿灰色 | 绿白色 | 较厚 | 有 | 圆形,波浪边缘,表面不光滑 |
| CM008 | +++ | 绿白色 | 中等黄色 | 浅绿灰色 | 绿白色 | 适中 | 无 | 圆形,波浪边缘,表面不光滑,较多褶皱 |
| CM0011 | ++++ | 灰黄棕色 | 绿白色 | 灰黄棕色 | 黄白色 | 较厚 | 无 | 圆形,波浪边缘,表面较光滑 |
| 查氏-蔗糖 Charlery - sucrose | ++ | 绿白色 | 淡绿色 | 绿白色 | 绿白色 | 较薄 | 无 | 圆形,波浪边缘,表面较光滑 |
表3 FIM18-0592培养特征
Table 3 Culture characteristics of FIM18-0592
| 培养基 Medium | 生长状态 Growth state | 表面颜色 Surface color | 背面颜色 Back color | 气生菌丝 Aerial mycelium | 基质菌丝 Substrate mycelium | 产孢情况 Spore production situation | 可溶性色素 Soluble pigment | 质地 Texture |
|---|---|---|---|---|---|---|---|---|
| ISP1 | +++ | 绿白色 | 绿白色 | 浅绿灰色 | 绿白色 | 适中 | 无 | 圆形,波浪边缘,表面不光滑 |
| ISP2 | ++++ | 绿灰色 | 中等黄褐色 | 绿灰色 | 绿白色 | 较厚 | 有 | 圆形,波浪边缘,表面不光滑,较多褶皱 |
| ISP3 | ++++ | 绿灰色 | 浅绿灰色 | 绿灰色 | 绿白色 | 较厚 | 无 | 圆形,锯形边缘,表面不光滑 |
| ISP4 | ++++ | 灰黄绿 | 黄灰色 | 灰黄绿 | 绿白色 | 较厚 | 有 | 圆形,锯形边缘,表面不光滑 |
| ISP5 | ++++ | 浅绿灰色 | 绿白色 | 浅绿灰色 | 绿白色 | 较厚 | 无 | 圆形,锯形边缘,表面不光滑 |
| ISP6 | +++ | 绿白色 | 深黄色 | 绿白色 | 绿白色 | 较薄 | 无 | 圆形,波浪边缘,表面较光滑 |
| ISP7 | ++++ | 浅灰黄色 | 深黄褐色 | 浅灰黄色 | 浅灰黄色 | 适中 | 有 | 圆形,波浪边缘,表面光滑 |
| G1 | ++++ | 灰黄绿 | 浅绿灰色 | 灰黄绿 | 淡黄绿色 | 较厚 | 有 | 圆形,波浪边缘,表面光滑 |
| PDA | ++++ | 绿灰色 | 绿灰色 | 绿灰色 | 绿白色 | 较厚 | 有 | 圆形,波浪边缘,表面不光滑 |
| CM008 | +++ | 绿白色 | 中等黄色 | 浅绿灰色 | 绿白色 | 适中 | 无 | 圆形,波浪边缘,表面不光滑,较多褶皱 |
| CM0011 | ++++ | 灰黄棕色 | 绿白色 | 灰黄棕色 | 黄白色 | 较厚 | 无 | 圆形,波浪边缘,表面较光滑 |
| 查氏-蔗糖 Charlery - sucrose | ++ | 绿白色 | 淡绿色 | 绿白色 | 绿白色 | 较薄 | 无 | 圆形,波浪边缘,表面较光滑 |
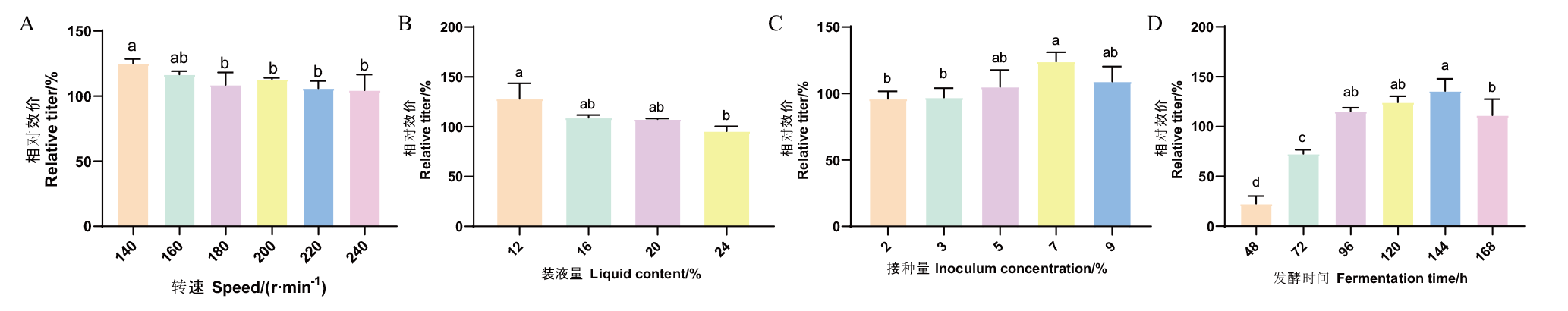
图3 不同发酵条件的考察 不同小写字母表示差异显著(P<0.05),下同
Fig. 3 Investigation of different fermentation conditions Different lowercase letters indicate significant difference at 0.05 level. The same below
| 分组Group | 葡萄糖Glucose/(g·L-1) | 黄豆饼粉Soybean cake powder/(g·L-1) | 硫酸铵(NH4)2SO4/(g·L-1) | 相对效价Relative titer/% |
|---|---|---|---|---|
| 1 | 60 | 10 | 2.0 | 104 |
| 2 | 80 | 15 | 2.5 | 114 |
| 3 | 100 | 20 | 3.0 | 136 |
| 4 | 120 | 25 | 3.5 | 31 |
| 5 | 140 | 30 | 4.0 | 15 |
表4 最陡爬坡试验设计及结果
Table 4 Design and results of steepest-climbing test
| 分组Group | 葡萄糖Glucose/(g·L-1) | 黄豆饼粉Soybean cake powder/(g·L-1) | 硫酸铵(NH4)2SO4/(g·L-1) | 相对效价Relative titer/% |
|---|---|---|---|---|
| 1 | 60 | 10 | 2.0 | 104 |
| 2 | 80 | 15 | 2.5 | 114 |
| 3 | 100 | 20 | 3.0 | 136 |
| 4 | 120 | 25 | 3.5 | 31 |
| 5 | 140 | 30 | 4.0 | 15 |
| 分组Group | A:葡萄糖Glucose/(g·L-1) | B:黄豆饼粉Soybean cake powder/(g·L-1) | C:硫酸铵(NH4)2SO4/(g·L-1) | 相对效价Relative titer(Y) |
|---|---|---|---|---|
| 1 | 1 | 1 | 0 | 145.79±37.27 |
| 2 | 0 | 0 | 0 | 163.10±10.45 |
| 3 | -1 | -1 | 0 | 146.09±11.86 |
| 4 | 1 | 0 | -1 | 134.75±13.15 |
| 5 | 0 | 0 | 0 | 165.58±1.63 |
| 6 | 0 | 0 | 0 | 153.91±16.84 |
| 7 | 0 | 1 | 1 | 25.25±0.59 |
| 8 | 0 | 0 | 0 | 158.94±5.90 |
| 9 | -1 | 1 | 0 | 37.32±1.45 |
| 10 | 1 | -1 | 0 | 138.31±1.15 |
| 11 | 1 | 0 | 1 | 135.49±7.29 |
| 12 | -1 | 0 | -1 | 153.49±1.61 |
| 13 | 0 | 1 | -1 | 146.57±13.94 |
| 14 | 0 | -1 | -1 | 140.41±2.33 |
| 15 | -1 | 0 | 1 | 49.91±8.92 |
| 16 | 0 | -1 | 1 | 148.60±12.41 |
| 17 | 0 | 0 | 0 | 154.04±1.46 |
表5 响应面实验设计及结果
Table 5 Response surface design and test results
| 分组Group | A:葡萄糖Glucose/(g·L-1) | B:黄豆饼粉Soybean cake powder/(g·L-1) | C:硫酸铵(NH4)2SO4/(g·L-1) | 相对效价Relative titer(Y) |
|---|---|---|---|---|
| 1 | 1 | 1 | 0 | 145.79±37.27 |
| 2 | 0 | 0 | 0 | 163.10±10.45 |
| 3 | -1 | -1 | 0 | 146.09±11.86 |
| 4 | 1 | 0 | -1 | 134.75±13.15 |
| 5 | 0 | 0 | 0 | 165.58±1.63 |
| 6 | 0 | 0 | 0 | 153.91±16.84 |
| 7 | 0 | 1 | 1 | 25.25±0.59 |
| 8 | 0 | 0 | 0 | 158.94±5.90 |
| 9 | -1 | 1 | 0 | 37.32±1.45 |
| 10 | 1 | -1 | 0 | 138.31±1.15 |
| 11 | 1 | 0 | 1 | 135.49±7.29 |
| 12 | -1 | 0 | -1 | 153.49±1.61 |
| 13 | 0 | 1 | -1 | 146.57±13.94 |
| 14 | 0 | -1 | -1 | 140.41±2.33 |
| 15 | -1 | 0 | 1 | 49.91±8.92 |
| 16 | 0 | -1 | 1 | 148.60±12.41 |
| 17 | 0 | 0 | 0 | 154.04±1.46 |
| 来源Source | 平方和Sum of squares | 自由度 Df | 均方Mean square | F | P |
|---|---|---|---|---|---|
| 模型Model | 31 930.65 | 9 | 3 547.85 | 83.14 | < 0.000 1 |
| A-葡萄糖 | 3 508.21 | 1 | 3 508.21 | 82.21 | < 0.000 1 |
| B-黄豆饼粉 | 5 967.02 | 1 | 5 967.02 | 139.83 | < 0.000 1 |
| C-硫酸铵 | 5 830.98 | 1 | 5 830.98 | 136.64 | < 0.000 1 |
| AB | 3 378.32 | 1 | 3 378.32 | 79.17 | < 0.000 1 |
| AC | 2 721.11 | 1 | 2 721.11 | 63.76 | < 0.000 1 |
| BC | 4 193.53 | 1 | 4 193.53 | 98.27 | < 0.000 1 |
| A2 | 1 604.43 | 1 | 1 604.43 | 37.60 | 0.000 5 |
| B2 | 2 173.81 | 1 | 2 173.81 | 50.94 | 0.000 2 |
| C2 | 1 890.01 | 1 | 1 890.01 | 44.29 | 0.000 3 |
| 失拟Lack of fit | 188.18 | 3 | 62.73 | 2.27 | 0.222 5 |
| 残差误差Residual error | 298.72 | 7 | 42.67 | R2=0.990 7 | |
| 纯误差Pure error | 110.54 | 4 | 27.64 | Adj R2=0.978 8 | |
| 合计 Total | 32 229.37 | 16 |
表6 回归方程方差分析和显著性误差
Table 5 Variance analysis and significance error of regression equation
| 来源Source | 平方和Sum of squares | 自由度 Df | 均方Mean square | F | P |
|---|---|---|---|---|---|
| 模型Model | 31 930.65 | 9 | 3 547.85 | 83.14 | < 0.000 1 |
| A-葡萄糖 | 3 508.21 | 1 | 3 508.21 | 82.21 | < 0.000 1 |
| B-黄豆饼粉 | 5 967.02 | 1 | 5 967.02 | 139.83 | < 0.000 1 |
| C-硫酸铵 | 5 830.98 | 1 | 5 830.98 | 136.64 | < 0.000 1 |
| AB | 3 378.32 | 1 | 3 378.32 | 79.17 | < 0.000 1 |
| AC | 2 721.11 | 1 | 2 721.11 | 63.76 | < 0.000 1 |
| BC | 4 193.53 | 1 | 4 193.53 | 98.27 | < 0.000 1 |
| A2 | 1 604.43 | 1 | 1 604.43 | 37.60 | 0.000 5 |
| B2 | 2 173.81 | 1 | 2 173.81 | 50.94 | 0.000 2 |
| C2 | 1 890.01 | 1 | 1 890.01 | 44.29 | 0.000 3 |
| 失拟Lack of fit | 188.18 | 3 | 62.73 | 2.27 | 0.222 5 |
| 残差误差Residual error | 298.72 | 7 | 42.67 | R2=0.990 7 | |
| 纯误差Pure error | 110.54 | 4 | 27.64 | Adj R2=0.978 8 | |
| 合计 Total | 32 229.37 | 16 |

图5 各因素对菌株FIM18-0592产格尔德霉素影响的响应面和等高线图
Fig. 5 Response surface and contour map of the effects of various factors on the production of geldanamycin by strain FIM18-0592
| [1] | 廖志勇, 甄永苏. 热休克蛋白90抑制剂Geldanamycin的抗肿瘤作用研究进展[J]. 药学学报, 2001, 36(9): 716-720. |
|
Liao ZY, Zhen YS. Advances in antitumor activity of the hsp90 inhibitor geldanamycin[J]. Acta Pharm Sin, 2001, 36(9): 716-720.
pmid: 12580116 |
|
| [2] |
DeBoer C, Meulman PA, Wnuk RJ, et al. Geldanamycin, a new antibiotic[J]. J Antibiot, 1970, 23(9): 442-447.
pmid: 5459626 |
| [3] | 李震宇. 格尔德霉素衍生物的设计、合成及抗肿瘤活性研究[D]. 济南: 山东大学, 2014. |
| Li ZY. Design, synthesis and antitumor activity of geldanamycin derivatives[D]. Jinan: Shandong University, 2014. | |
| [4] |
Lewis J, Devin A, Miller A, et al. Disruption of hsp90 function results in degradation of the death domain kinase, receptor-interacting protein(RIP), and blockage of tumor necrosis factor-induced nuclear factor-kappaB activation[J]. J Biol Chem, 2000, 275(14):10519-10526.
doi: 10.1074/jbc.275.14.10519 pmid: 10744744 |
| [5] | 程春雷, 游雪甫, 王跃明, 等. 固相萃取-HPLC法研究格尔德霉素在Beagle犬药代动力学[J]. 药物分析杂志, 2005, 25(4): 409-412. |
| Cheng CL, You XF, Wang YM, et al. Pharmacokinetics of geldanamycin in beagle dogs by solid phase extraction-HPLC method[J]. Chin J Pharm Anal, 2005, 25(4): 409-412. | |
| [6] | 王明艳. Hygrocins生物合成基因簇中关键基因的初步研究[D]. 华中农业大学, 2017. |
| Wang MY. Preliminary study on the key genes in the Hygrocins biosynthetic gene cluster[D]. Wuhan: Huazhong Agricultural University, 2017. | |
| [7] |
Sasaki K, Yasuda H, Onodera K. Growth inhibition of virus transformed cells in vitro and antitumor activity in vivo of geldanamycin and its derivatives[J]. J Antibiot, 1979, 32(8): 849-851.
pmid: 500504 |
| [8] |
Kozeko LE. Phenotypic variability of Arabidopsis thaliana seedlings as a result of inhibition of Hsp90 chaperones[J]. Tsitol Genet, 2013, 47(2): 18-33.
pmid: 23745360 |
| [9] | 王闪, 郑禹轩, 刘冬杪, 等. 格尔德霉素(GDA)能导致小麦基因组DNA多态性和甲基化修饰增加[J]. 种子, 2016, 35(5):1-4. |
| Wang S, Zheng YX, Liu DM, et al. Geldanamycin(GDA)induce the increase of genomic DNA polymorphism and DNA methylation in Triticum aestivum L[J]. Seed, 2016, 35(5): 1-4. | |
| [10] | Díaz-Cruz GA, Liu JY, Tahlan K, et al. Nigericin and geldanamycin are phytotoxic specialized metabolites produced by the plant pathogen Streptomyces sp. 11-1-2[J]. Microbiol Spectr, 2022, 10(2): e0231421. |
| [11] |
Heisey RM, Putnam AR. Herbicidal effects of geldanamycin and nigericin, antibiotics from Streptomyces hygroscopicus[J]. J Nat Prod, 1986, 49(5): 859-865.
pmid: 3819734 |
| [12] | Qian H, Qi W, Cui J, et al. Fermentation optimization and amylase activity of endophytic Bacillus velezensis D1 isolated from corn seeds[J]. J Appl Microbiol, 2022, 132(5): 3640-3649. |
| [13] |
Yanbo L, Yafei W, Haideng L, et al. Optimization of fermentation technology for composite fruit and vegetable wine by response surface methodology and analysis of its aroma components[J]. RSC advances, 2022, 12(55): 35616-35626.
doi: 10.1039/d2ra04294k pmid: 36545074 |
| [14] | 刘婷婷. 稻瘟病生防放线菌的分离鉴定及液体发酵条件的优化[D]. 长春: 吉林农业大学, 2020. |
| Liu TT. Isolation and identification of biocontrol actinomycetes against rice blast and optimization of liquid fermentation conditions[D]. Changchun: Jilin Agricultural University, 2020. | |
| [15] | Chen YT, Yang DD, Ouyang NF, et al. Optimization of limonin invertase production by scaling up Aspergillus tabingensis UA13 fermentation to a 5-l scale[J]. Lett Appl Microbiol, 2023, 76(12): 12. |
| [16] |
周剑, 孙菲, 方志锴, 等. 小分子前体物对巴弗洛霉素A1生物合成的影响[J]. 生物技术通报, 2019, 35(6): 125-130.
doi: 10.13560/j.cnki.biotech.bull.1985.2018-1001 |
|
Zhou J, Sun F, Fang ZK, et al. Effects of small molecule precursors on bafilomycin A1 biosynthesis[J]. Biotechnol Bull, 2019, 35(6): 125-130.
doi: 10.13560/j.cnki.biotech.bull.1985.2018-1001 |
|
| [17] | 朱皖宜, 陈华, 邱海潇, 等. 格尔德霉素高产菌株的抗性筛选及其发酵的研究[J]. 中国抗生素杂志, 2014, 39(2): 106-109, 145. |
| Zhu WY, Chen H, Qiu HX, et al. Resistance screening of geldanamycin high-yielding mutant strain and fermentation optimization[J]. Chin J Antibiot, 2014, 39(2): 106-109, 145. | |
| [18] | 赫卫清, 刘玉瑛, 孙桂芝, 等. 格尔德霉素生物合成基因功能的验证[J]. 生物工程学报, 2008, 24(7): 1133-1139. |
| He WQ, Liu YY, Sun GZ, et al. Roles of geldanamycin biosynthetic genes in Streptomyces hygroscopicus 17997[J]. Chin J Biotechnol, 2008, 24(7): 1133-1139. | |
| [19] | 王冀民, 钱思宇, 马婕, 等. 格尔德霉素发酵工艺研究[J]. 齐鲁药事, 2009, 28(7): 433-435. |
| Wang JM, Qian SY, Ma J, et al. Study on fermentation technological conditions of geldanamycin[J]. Qilu Pharm Aff, 2009, 28(7): 433-435. | |
| [20] | 林惠敏, 尹培军, 李继安, 等. 格尔德霉素发酵工艺的优化[J]. 中国抗生素杂志, 2012, 37(2): 112-115, 144. |
| Lin HM, Yin PJ, Li JA, et al. Studies on fermentation process of geldanamycin[J]. Chin J Antibiot, 2012, 37(2): 112-115, 144. | |
| [21] | 刘涛. 格尔德霉素制备工艺的研究[D]. 郑州: 河南工业大学, 2010. |
| Liu T. The studies on the preparation of geldanamycin[D]. Zhengzhou: Henan University of Technology, 2010. | |
| [22] |
吴隽松, 滕飞翔, 杨留才. 响应面法优化柘果白兰地原酒发酵条件[J]. 中国酿造, 2024, 43(2): 216-220.
doi: 10.11882/j.issn.0254-5071.2024.02.033 |
| Wu JS, Teng FX, Yang LC. Optimization of brewing process of cudrania tricuspidata brandy original wine by response surface method[J]. China Brewing, 2024, 43(2): 216-220. | |
| [23] | 项仁鑫, 孙鹏, 杨小虎, 等. PF1022A产生菌的菌种选育及培养基优化[J]. 中国抗生素杂志, 2023, 48(9): 1017-1023. |
| Xiang RX, Sun P, Yang XH, et al. Mutation breeding and optimization of fermentation medium of PF1022A producing strain[J]. Chin J Antibiot, 2023, 48(9): 1017-1023. | |
| [24] | 张晓元, 张艳艳, 孙晓康, 等. 响应面法优化吸水链霉菌产雷帕霉素发酵培养基[J]. 食品与药品, 2023, 25(1): 1-5. |
| Zhang XY, Zhang YY, Sun XK, et al. Optimization of Streptomyces hygroscopicus medium for production of rapamycin by response surface methodology[J]. Food Drug, 2023, 25(1): 1-5. | |
| [25] | 阮继生, 黄英. 放线菌快速鉴定与系统分类[M]. 北京: 科学出版社, 2011. |
| Ruan JS, Huang Y. Rapid identification and systematics of actinobacteria[M]. Beijing: Science Press, 2011. | |
| [26] |
Bérdy J. Bioactive microbial metabolites- A personal view[J]. J Antibiot, 2005, 58(1): 1-26.
doi: 10.1038/ja.2005.1 pmid: 15813176 |
| [27] | Zeng HW, Qiao J, Zeng X, et al. Optimization of submerged and solid state culture conditions for Monascuspigment production and characterization of its composition and antioxidant activity[J]. Pigment Resin Technol, 2019, 48(2): 108-118. |
| [28] | 苏辉兰, 莫雪雪, 余炳锋, 等. 贡柑果园高效解磷菌的筛选及其解磷条件优化[J]. 北方园艺, 2019(5): 101-107. |
| Su HL, Mo XX, Yu BF, et al. Isolation and culture condition of phosphate-solubilizing bacteria derived from Gonggan orchard[J]. North Hortic, 2019(5): 101-107. | |
| [29] | 王志伟, 郭尚, 侯雷平, 等. 响应面法优化大白桩菇液体发酵工艺[J]. 山西农业科学, 2022, 50(3): 424-432. |
| Wang ZW, Guo S, Hou LP, et al. Optimization of liquid fermentation process of Leucopaxillus giganteus by response surface[J]. J Shanxi Agric Sci, 2022, 50(3): 424-432. | |
| [30] |
蒲丹丹, 李艳, 赵丽红, 等. 简青霉CEF-818固体发酵工艺优化[J]. 中国生物防治学报, 2022, 38(3): 636-644.
doi: 10.16409/j.cnki.2095-039x.2022.02.026 |
| Pu DD, Li Y, Zhao LH, et al. Optimization of solid-state fermentation process of Penicillium simplicissimum CEF-818[J]. Chin J Biol Contr, 2022, 38(3): 636-644. | |
| [31] |
李晓敏, 袁源, 薛帆正, 等. 粗毛纤孔菌产胞外黑色素发酵条件优化及其抗氧化活性研究[J]. 核农学报, 2023, 37(3): 531-539.
doi: 10.11869/j.issn.1000-8551.2023.03.0531 |
| Li XM, Yuan Y, Xue FZ, et al. Optimization of fermentation conditions for extracellular melanin production from Inonotus hispidus and its antioxidant activity[J]. J Nucl Agric Sci, 2023, 37(3): 531-539. | |
| [32] | 孙志敏, 李昱龙, 沈紫竹, 等. 樟疫霉拮抗链霉菌S-03菌株发酵条件优化及其稳定性探究[J]. 生命科学研究, 2022, 26(3): 256-263. |
| Sun ZM, Li YL, Shen ZZ, et al. Fermentation condition optimization and stability of Streptomyces S-03 strain, a Phytophthora cinnamomi antagonist[J]. Life Sci Res, 2022, 26(3): 256-263. | |
| [33] |
唐小华, 祁姣姣, 朱剑锋, 等. 高产腺嘌呤核苷酸菌株的筛选及发酵工艺优化[J]. 中国酿造, 2023, 42(5): 105-112.
doi: 10.11882/j.issn.0254-5071.2023.05.016 |
| Tang XH, Qi JJ, Zhu JF, et al. Screening and fermentation process optimization of high yield adenine nucleotide strain[J]. China Brew, 2023, 42(5): 105-112. |
| [1] | 徐伟芳, 李贺宇, 张慧, 何仔昂, 高文恒, 谢紫洋, 王传文, 尹登科. 生防细菌HX0037对栝楼炭疽病的防病能力及其机制[J]. 生物技术通报, 2024, 40(4): 228-241. |
| [2] | 程亚楠, 张文聪, 周圆, 孙雪, 李玉, 李庆刚. 乳酸乳球菌生产2'-岩藻糖基乳糖的途径构建及发酵培养基优化[J]. 生物技术通报, 2023, 39(9): 84-96. |
| [3] | 车永梅, 刘广超, 郭艳苹, 叶青, 赵方贵, 刘新. 一种耐盐复合菌剂的制备和促生作用研究[J]. 生物技术通报, 2023, 39(11): 217-225. |
| [4] | 孙卓, 王妍, 韩忠明, 王云贺, 赵淑杰, 杨利民. 防风根际真菌的分离鉴定及其生防潜力评价[J]. 生物技术通报, 2023, 39(1): 264-273. |
| [5] | 黄海辰, 李晓敏, 薛帆正, 吴小平, 张君丽, 傅俊生. 一株高产黑色素香灰菌菌株的鉴定、筛选及培养条件的优化[J]. 生物技术通报, 2023, 39(1): 284-294. |
| [6] | 符勇耀, 易德燕, 杨先茂, 蔡莉, 梁渝华, 雷美艳, 杨利平. 卷丹新种质JD-h-15的形态特征与遗传变异分析[J]. 生物技术通报, 2022, 38(11): 140-150. |
| [7] | 张瑶心, 王亮节, 郑文, 徐汉琴, 郑恋, 钟静. 产几丁质酶的无色杆菌ZWW8的发酵产酶及酶学性质研究[J]. 生物技术通报, 2021, 37(4): 96-106. |
| [8] | 吴蓉, 曹佳睿, 曹君, 刘飞翔, 杨猛, 苏二正. 南极假丝酵母脂肪酶B基因在大肠杆菌中的表达和发酵优化[J]. 生物技术通报, 2021, 37(2): 138-148. |
| [9] | 李静舒, 赵佳. 生防细菌ML-3抗菌蛋白发酵条件的优化及其防治应用[J]. 生物技术通报, 2020, 36(6): 83-92. |
| [10] | 韩唱,宿玲恰,吴敬. Sulfolobus acidocaldarius ATCC 33909麦芽寡糖基海藻糖合成酶在Bacillus subtilis中的重组表达和发酵优化[J]. 生物技术通报, 2017, 33(7): 162-168. |
| [11] | 饶德明, 张良程, 陈久洲, 孙德虎, 孙村民, 郑小梅, 郑平, 刁爱坡. 谷氨酸棒状杆菌合成5-氨基乙酰丙酸的途径构建与发酵优化[J]. 生物技术通报, 2017, 33(1): 148-156. |
| [12] | 李光磊, 张娟, 方真, 隆明星, 堵国成, 陈坚. 嗜麦芽寡养单胞菌角蛋白酶基因在毕赤酵母中的表达[J]. 生物技术通报, 2016, 32(8): 152-160. |
| [13] | 王慧, 崔云风, 刘岩, 史吉平, 赵志军, 王绍明. MntH与含锰过氧化氢酶共表达基因工程菌的构建与发酵优化[J]. 生物技术通报, 2015, 31(9): 183-189. |
| [14] | 朱海峰, 吴丹, 吴敬. 毕赤酵母GS115中N-乙酰转移酶在大肠杆菌中的克隆表达与性质研究[J]. 生物技术通报, 2015, 31(11): 179-185. |
| [15] | 柴秀娟,李曹龙,孔德真,崔郑龙,王爱英. 产纤维素酶菌株的筛选、鉴定及产酶条件的优化[J]. 生物技术通报, 2014, 30(9): 164-170. |
| 阅读次数 | ||||||
|
全文 |
|
|||||
|
摘要 |
|
|||||